猪肾里长出人源肾单位?科学家用“迷你肾脏”迈出器官再生第一步
肾脏是人体的 净化工厂 ,一旦衰竭,只能依靠透析或移植维持生命。尽管类器官技术发展迅速,但其临床应用仍面临三大瓶颈:
● 难以规模化生产;
● 结构不均一;
● 移植后存活率低。
本研究的目标非常明确:建立一套可重复、可扩展的肾脏类器官培养体系,并验证其在大型动物肾脏中的移植可行性。这不仅是为了推动类器官从实验室走向临床,更是为未来 器官修复 提供一种全新的细胞治疗策略。
干细胞、类器官与猪肾的 三方会谈
研究者使用了人多能干细胞作为起点,通过的诱导分化,将其转变为肾脏前体细胞,进而自组织成 肾脏类器官 。为了验证其移植效果,他们选择了与人类肾脏结构相似的猪肾脏作为 宿主器官 ,利用 常温机器灌注系统 模拟体内环境,进行类器官的移植与观察。
整个研究分为三个阶段:
阶段一:打造高质量的肾脏类器官
研究者首先优化了培养条件,通过调控细胞密度与生长因子,诱导干细胞分化为 后期间充质 ,即肾脏发育的起点。接着,他们将不同数量的细胞(500、8000、10万、25万)聚集为3D球体,在悬浮培养中观察其自组织能力。
结果发现,由500个细胞形成的类器官分化程度最高,表现出更丰富的肾单位结构(如肾小球、近端小管等),并且代谢状态更接近成熟肾脏细胞(倾向于氧化磷酸化代谢)。正如图1所示,这些 迷你肾脏 不仅形态规整,还表达了多种肾脏特异性标志物,如PAX2、LHX1、WT1等。
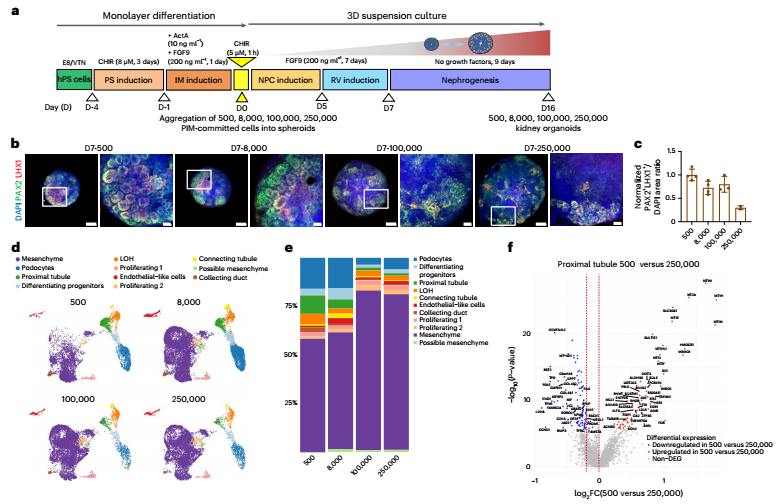
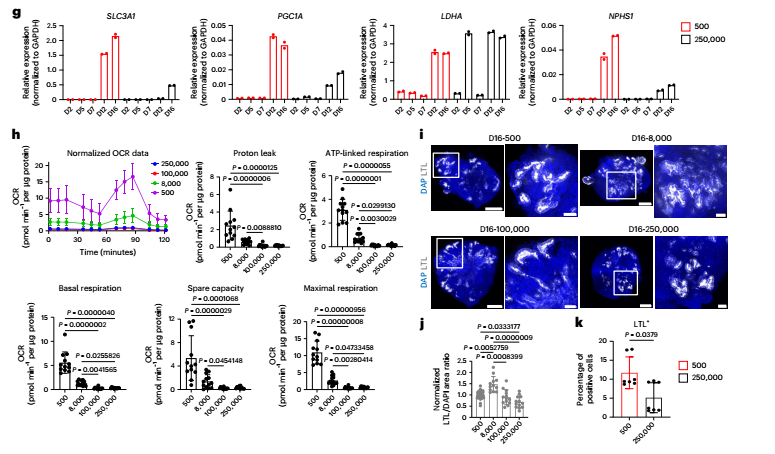 图:悬浮培养中肾脏类器官的生成
图:悬浮培养中肾脏类器官的生成
阶段二:规模化生产与 荧光标记 追踪
为了实现大规模生产,研究者开发了一种微孔板培养系统,能在24孔板中一次性生成约3万个结构均一的类器官。更酷的是,他们利用CRISPR-Cas9基因编辑技术,构建了WT1-GFP荧光报告细胞系,让肾小球前体细胞在分化过程中发出绿色荧光,便于实时追踪。
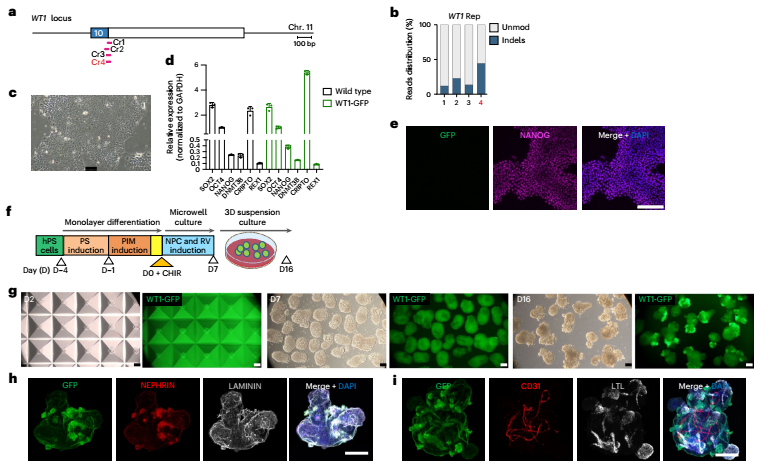
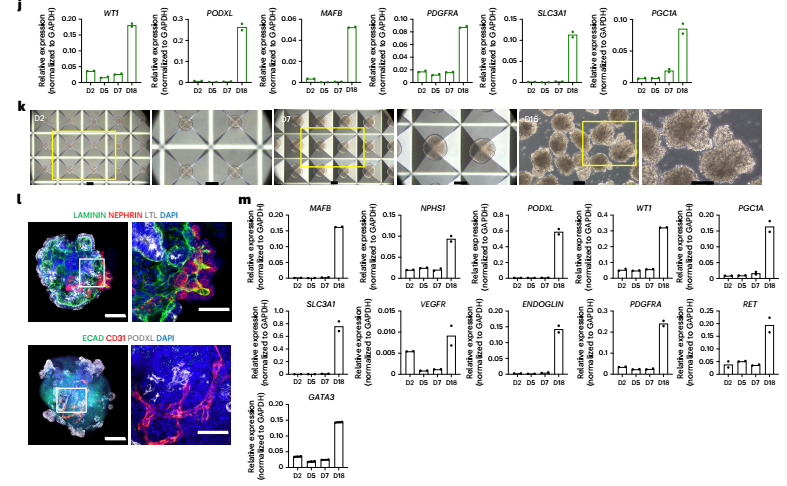 图:通过微聚合技术实现可扩展的均匀肾脏类器官生产
图:通过微聚合技术实现可扩展的均匀肾脏类器官生产
阶段三:移植挑战 把人类类器官 送进 猪肾里
这是最具挑战的一步。研究者将标记好的人类类器官通过肾动脉注入猪肾脏,并在体外灌注系统中维持其生理状态。结果显示:
● 类器官成功定植在猪肾的皮质区;
● 人类细胞在猪肾中存活至少48小时;
● 未引起明显的免疫排斥或肾功能损伤。
通过荧光成像、组织切片与流式细胞术等多种手段,研究者确认了人类细胞在猪肾中的存在与分布,并进一步评估了移植后猪的血液、尿液指标,发现其肾功能基本稳定,未出现严重异常。
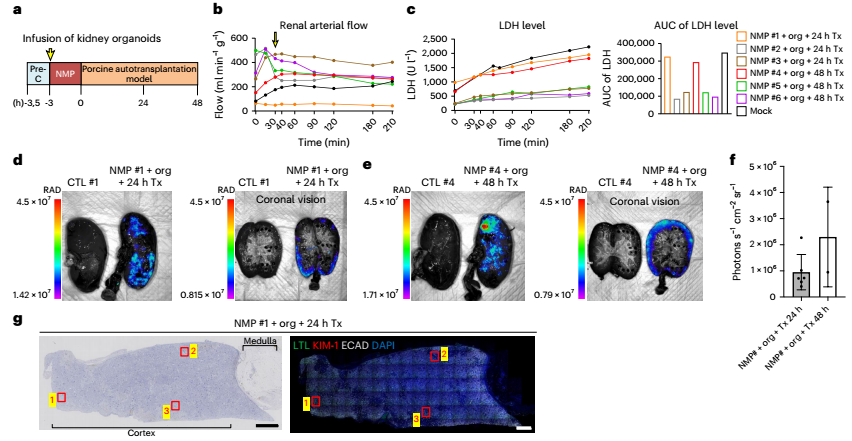
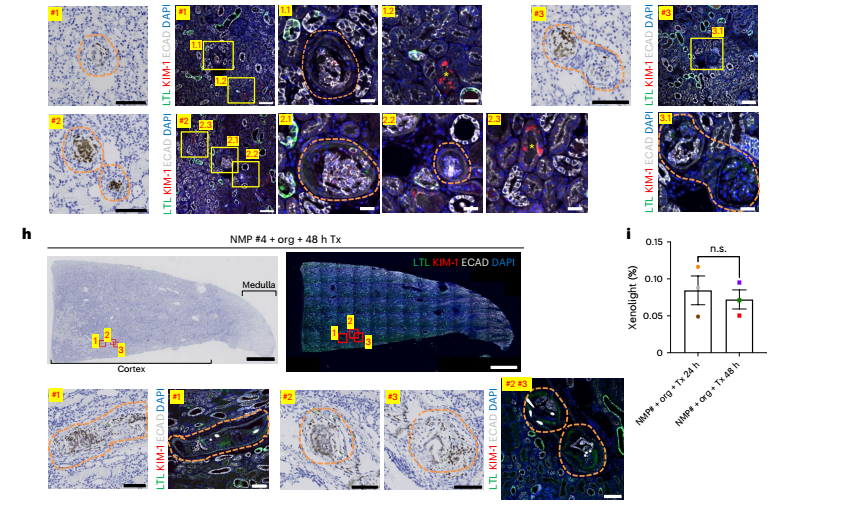 图:将注入人肾类器官的猪肾进行体内移植
图:将注入人肾类器官的猪肾进行体内移植
小结
这项研究不仅是技术上的突破,更是理念上的跨越。它告诉我们:
● 我们可以 定制 肾脏类器官,且质量可控、规模可观;
● 类器官可以在大型动物肾脏中短期存活,为后续长期研究打下基础;
● 机器灌注系统是理想的 移植前训练营 ,为类器官提供了接近体内的环境。
当然,研究者也坦言,目前还处于 概念验证 阶段。类器官能否长期存活、是否具备功能、是否会引发远期免疫反应,都是未来需要回答的问题。但无论如何,这项研究已经为 肾脏再生医学 推开了一扇窗。
参考文献:
Garreta E, Moya-Rull D, Centeno A et al. Systematic production of human kidney organoids for transplantation in porcine kidneys during ex vivo machine perfusion. Nat Biomed Eng. 2025 Oct 31. doi: 10.1038/s41551-025-01542-1. Epub ahead of print. PMID: 41174010.
搜索资讯
热门资讯
最新资讯
2025-05-01 16:06:26
2025-05-01 16:06:26
2025-05-01 16:06:26
2025-05-01 16:06:26
2025-05-01 16:06:26
2025-05-01 16:06:26