治“冷肿瘤”有新招!Bioact Mater:益生菌纳米囊泡重塑免疫微环境,免疫治疗增效获人肺癌类器官佐证
治“冷肿瘤”有新招!Bioact Mater:益生菌纳米囊泡重塑免疫微环境,免疫治疗增效获人肺癌类器官佐证
来源:100医药网 2025-11-24 10:07
本研究构建益生菌启发的ROMV/TMAO杂化纳米囊泡,可靶向肿瘤并调控免疫微环境,联合PD-L1抑制剂在多种肿瘤模型和人肺癌类器官中显著增强免疫检查点治疗效果,为肿瘤免疫治疗提供新策略。免疫检查点治疗是恶性肿瘤治疗领域的重要突破,显著改善了黑色素瘤、非小细胞肺癌等患者的生存率。但胰腺癌等 冷肿瘤 因免疫抑制微环境明显、CD8+T细胞浸润不足,对该疗法的响应率一直处于较低水平。肠道菌群疗法虽能通过重塑微环境,将 冷肿瘤 转化为 热肿瘤 ,却存在细菌易移位引发感染、代谢产物难以定量控制等安全隐患。
Bioact Mater发表的一项研究Probiotic-inspired hybrid nanovesicles for enhancing immune checkpoint therapy efficiency via tumor immune microenvironment modulation为解决这一临床难题提供了全新的纳米治疗思路。

研究团队首先融合大肠杆菌分泌的外膜囊泡(OMV)与巨噬细胞膜载体(RV),构建出杂化纳米囊泡(ROMV),随后将肠道菌群代谢产物三甲胺N-氧化物(TMAO)包封其中,最终形成ROMV/TMAO纳米制剂。理化表征结果显示,OMV、ROMV、ROMV/TMAO的水动力直径分别为87.2 0.7纳米、90.1 0.9纳米和83.6 1.7纳米,zeta电位均呈负值,且在含10%血清的PBS溶液中孵育72小时后,粒径和多分散性指数仍能保持稳定。细胞实验进一步证实,ROMV/TMAO可被4T1细胞有效摄取,并且在6小时内就能成功逃逸溶酶体降解,为后续发挥作用奠定基础。
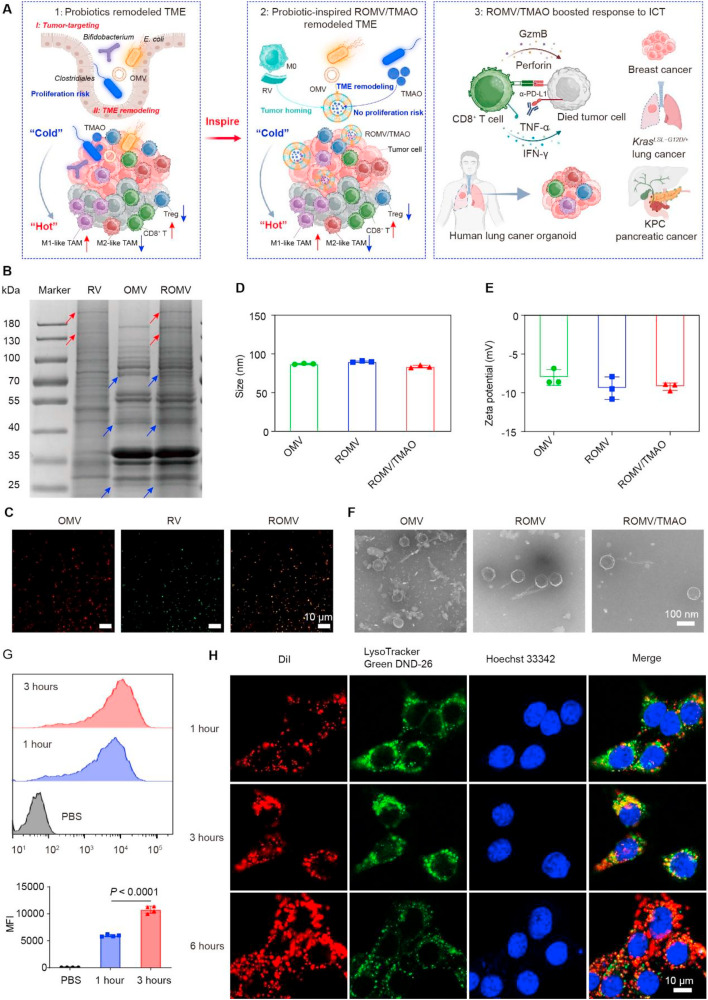
图1:ROMV/TMAO的设计与表征
在体内靶向性与生物安全性评估中,用DiR标记的ROMV/TMAO在4T1模型和KrasLSL-G12D/+肺癌模型里展现出突出的肿瘤靶向能力,24小时后肿瘤部位的荧光强度远高于游离DiR组。安全性方面,不同剂量ROMV/TMAO处理后的小鼠存活率均达到100%,体重未出现明显波动,肝肾功能指标、血液常规指标也都维持在正常范围。同时,该制剂还能减轻OMV引发的IL-6、TNF- 等炎症因子释放,且不会诱导TMAO相关的动脉粥样硬化风险,生物安全性得到充分验证。
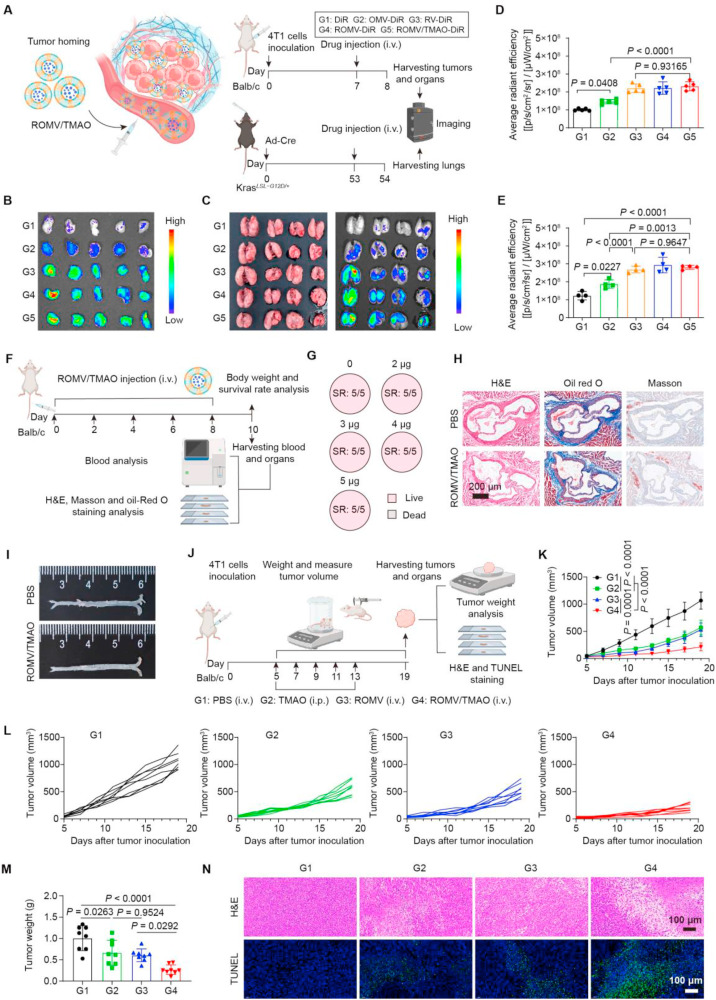
图2:ROMV/TMAO的肿瘤靶向能力、生物安全性及抑瘤效果评估
在4T1乳腺癌模型中,单独使用ROMV/TMAO治疗就展现出显著的肿瘤抑制效果。数据显示,该组小鼠的肿瘤重量仅为0.41 0.08克,远低于PBS对照组的1.20 0.10克。单细胞RNA测序结果表明,ROMV/TMAO处理后,肿瘤浸润免疫细胞中CD8+T细胞和M1样巨噬细胞的比例显著升高,Treg细胞和M2样巨噬细胞的比例则明显降低。
差异表达基因分析发现,免疫刺激基因、CD8+T细胞标记基因以及细胞毒性效应分子基因均被显著上调,I型干扰素和TLR通路核心基因的表达也出现明显增加。流式细胞术和免疫组化结果进一步验证,ROMV/TMAO能让肿瘤内M1样巨噬细胞比例增至34.6%,CD8+T细胞浸润率达到35.8 3.3%。当研究人员耗竭CD8+T细胞或巨噬细胞后,ROMV/TMAO的抑瘤效果大幅减弱,这一结果证实了这两种细胞是其发挥抗肿瘤作用的关键载体。
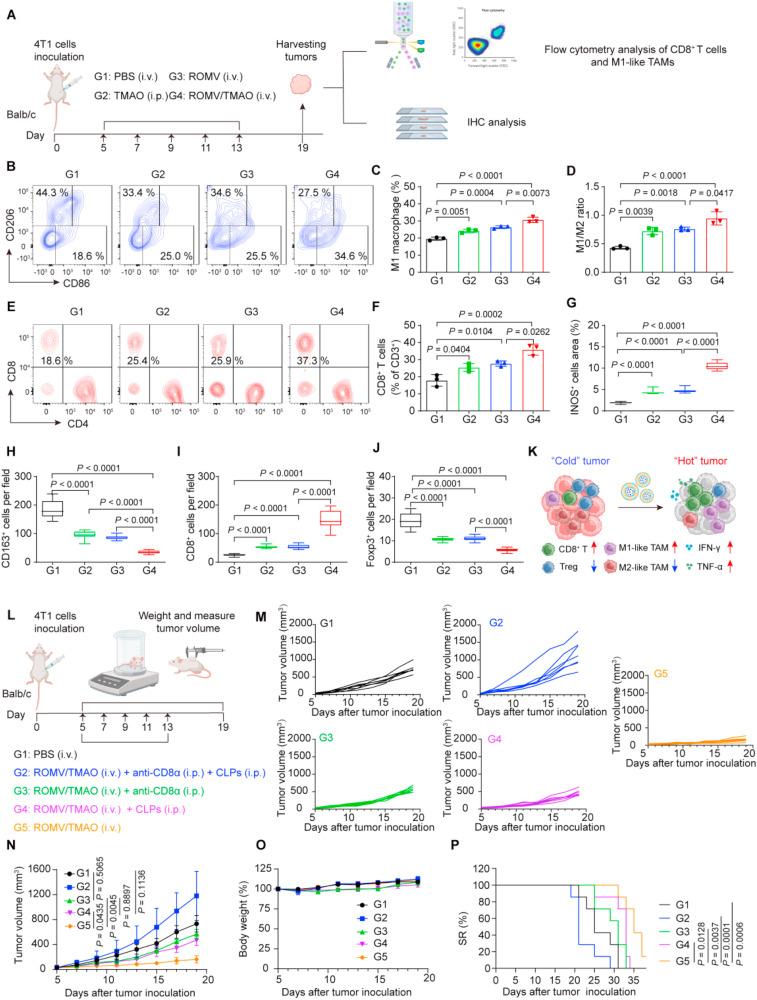
图3:ROMV/TMAO的体内免疫激活能力
研究团队还进一步探索了ROMV/TMAO与免疫检查点抑制剂 -PD-L1的联合治疗效果。在4T1乳腺癌、KrasLSL-G12D/+肺癌和KPC胰腺癌模型中,联合治疗组的肿瘤抑制效果均显著优于单药治疗组。其中在4T1模型中,联合治疗组小鼠的肿瘤重量比 -PD-L1单药组降低约50%;在KrasLSL-G12D/+肺癌模型中,肺组织的肿瘤面积大幅减少。同时,联合治疗组肿瘤内CD8+T细胞浸润进一步增加,Foxp3+Treg细胞比例降低,小鼠存活率显著提升,且整个治疗过程中未出现明显体重下降,体现出良好的生物相容性。
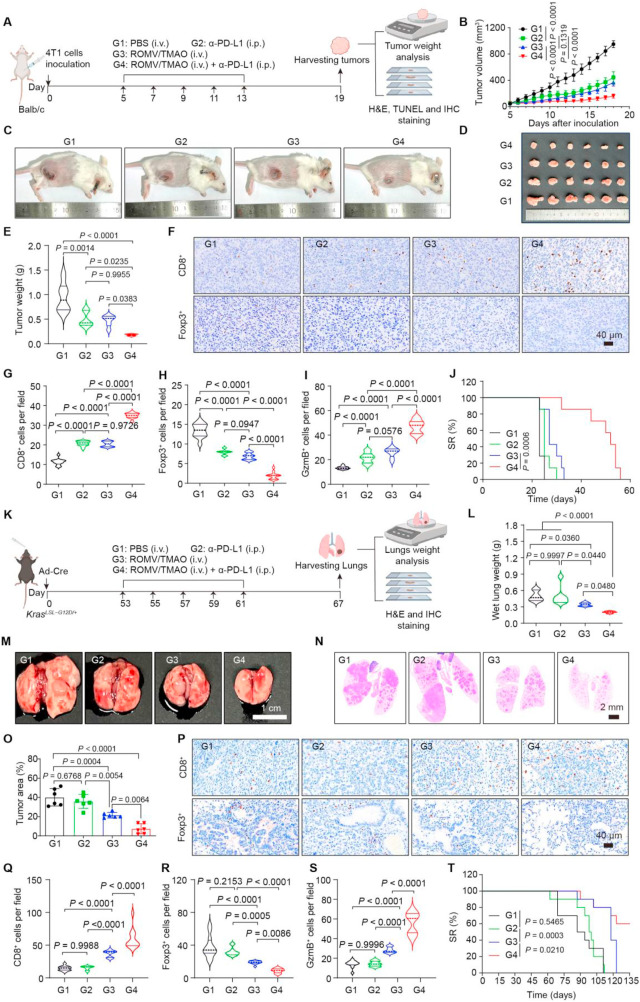
图4:ROMV/TMAO联合 -PD-L1在4T1乳腺癌模型和KrasLSL-G12D/+肺癌模型中的抑瘤效果
为验证该制剂的临床转化潜力,研究人员利用肺癌患者的肿瘤样本构建了人肺癌类器官,90这些类器官成功重现了原肿瘤的形态特征和标志物表达模式。共培养实验结果显示,ROMV/TMAO能有效促进人外周血单个核细胞中的CD8+T细胞向类器官内浸润;当联合 -PD-L1使用时,类器官内的死亡数量显著增加,IFN- 和颗粒酶B的水平也大幅升高,这一结果表明该纳米制剂在人源模型中同样能有效增强免疫检查点治疗效果。
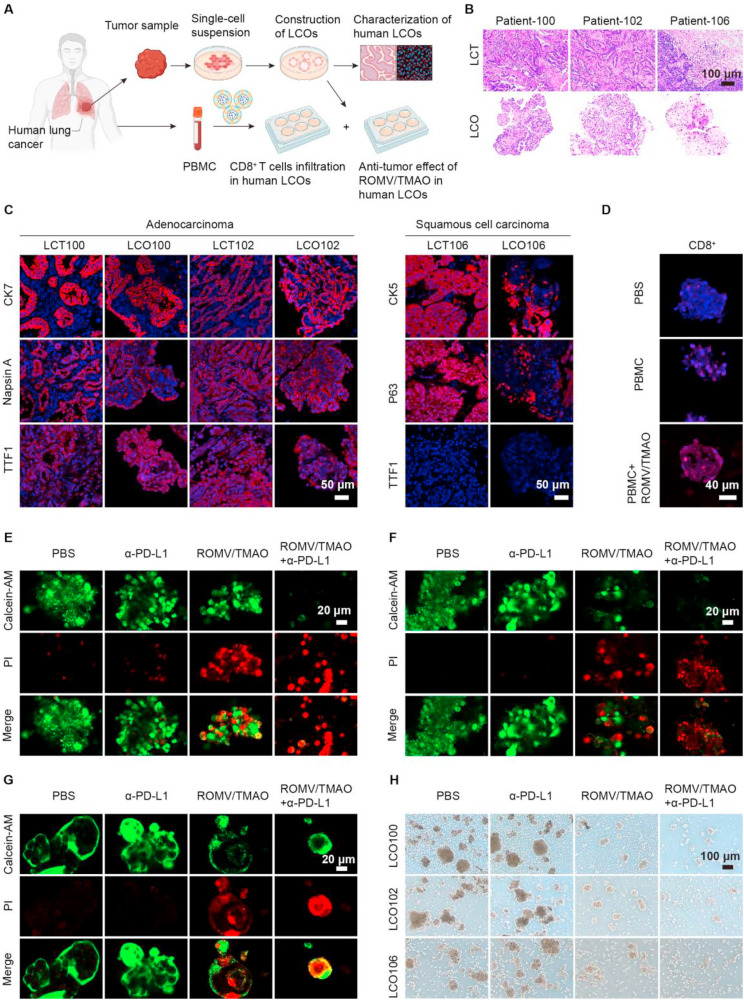
图5:ROMV/TMAO在人肺癌类器官中的抑瘤活性及CD8+T细胞浸润情况
这项研究创新性地将益生菌的免疫调节成分与纳米靶向技术相结合,成功构建出ROMV/TMAO杂化纳米囊泡。该制剂既保留了肠道菌群的免疫调控功能,又避开了活体益生菌可能带来的安全风险。通过靶向肿瘤、重塑肿瘤免疫微环境,ROMV/TMAO成功增强了免疫检查点治疗在多种 冷肿瘤 模型中的疗效,且在人肺癌类器官中展现出良好的应用前景。这一治疗策略不仅为肿瘤免疫治疗领域提供了新的工具,更为后续开发基于肠道菌群的纳米治疗平台奠定了基础,未来有望为更多难治性带来新的治疗希望。(100yiyao.com)
参考文献:
Wang F, Fan J, Pan W, et al. Probiotic-inspired hybrid nanovesicles for enhancing immune checkpoint therapy efficiency via tumor immune microenvironment modulation.Bioact Mater. 2025;56:197-216. Published 2025 Oct 17. doi:10.1016/j.bioactmat.2025.10.012
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
搜索资讯
热门资讯
最新资讯
2025-05-01 16:06:26
2025-05-01 16:06:26
2025-05-01 16:06:26
2025-05-01 16:06:26
2025-05-01 16:06:26
2025-05-01 16:06:26