南京大学最新Nature Chemistry论文:AI从头设计超稳定蛋白
来源:生物世界 2025-11-21 10:44
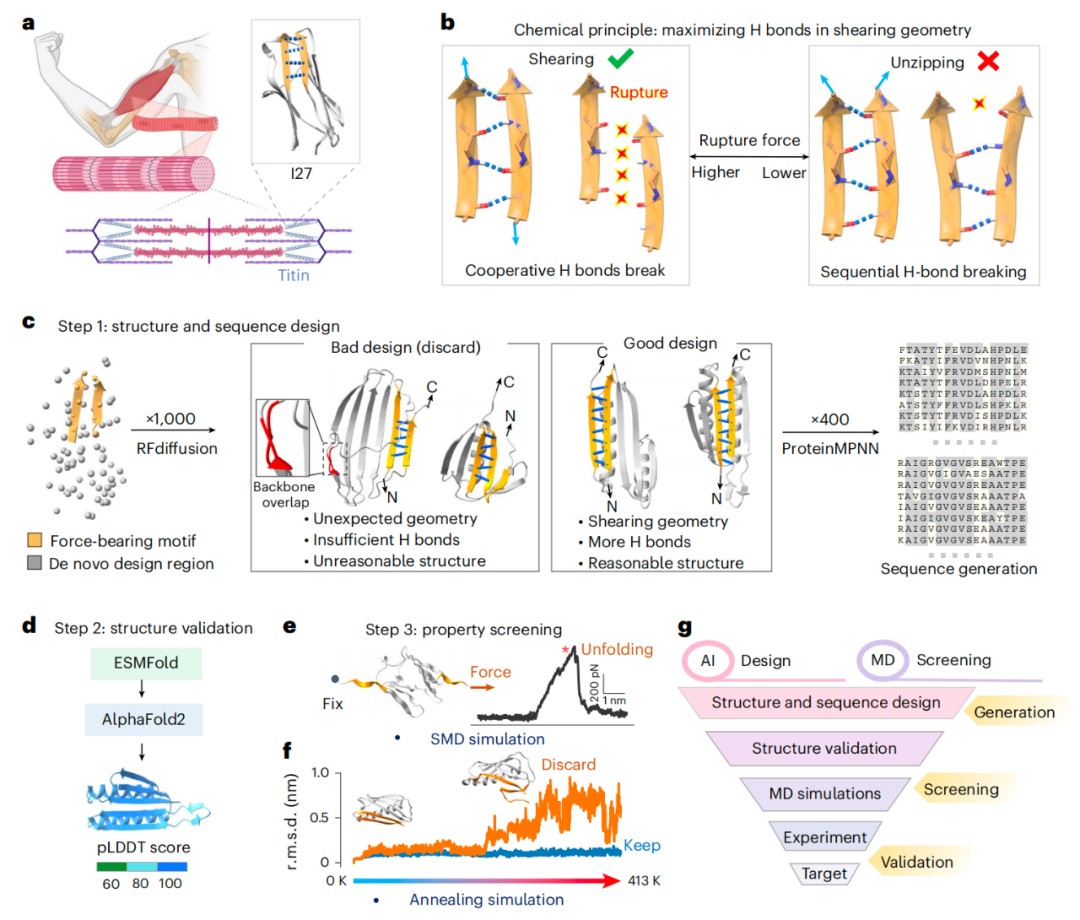
该研究提出了一种可扩展且高效的计算设计策略,用于从头设计稳健的蛋白质,为理性设计在极端环境中具有抗性的蛋白质系统提供了一种通用方法。氢键对于生物分子结构至关重要,尤其是在 -折叠片层中,它们的集体强度使蛋白质能够承受高强度的机械和环境压力。大自然进化出了多种机械稳定性极强的蛋白质,例如肌联蛋白球蛋白(Ig)结构域、丝素蛋白、蜘蛛丝 -折叠片以及细菌黏附复合物等,它们都利用其 -折叠结构内部广泛的氢键网络,在受力情况下展现出非凡的稳定性。
以肌联蛋白免疫球蛋白结构域为例,在动态力测定中,它通过在 -折叠链之间施加剪切力加载几何力,能够承受数百皮牛的力。然而,尽管在剪切力加载几何结构中氢键作用导致高机械稳定性的原理已在自然界中得到充分确立和证实,但系统性应用这一原理来设计合成具有纳牛级稳定性的蛋白质,仍是一项重大挑战。
2025 年 11 月 18 日,南京大学化学化工学院郑鹏教授团队,在Nature Chemistry期刊发表了题为:Computational design of superstable proteins through maximized hydrogen bonding的研究论文。
该研究通过融合人工智能、分子动力学模拟与单分子力谱技术,开创了一条全新的蛋白质设计路径,实现了对蛋白质力学稳定性的设计与性能跨越。

氢键是稳定蛋白质结构的基本化学相互作用,尤其是在 -折叠片层中,使蛋白质能够抵御机械应力和极端环境。例如,自然界中天然存在的肌联蛋白等,凭借其 -折叠片内密集的氢键网络,展现出卓越的机械性能。
受此启发,郑鹏教授团队基于在 AI + 蛋白质 设计领域的长期积累,开发出一套由 AI 驱动的计算蛋白质设计新方法。该方法结合 AI 引导的结构和序列设计以及全原子分子动力模拟的计算框架,系统地扩展了蛋白质结构,最大化主链氢键网络,将主链氢键的数量从 4 个增加到 33 个,从而实现了对蛋白质力学性能的 按需定制 。基于此策略,研究团队成功从头设计出名为 SuperMyo 的超稳定蛋白质,其性能远超天然同类蛋白。
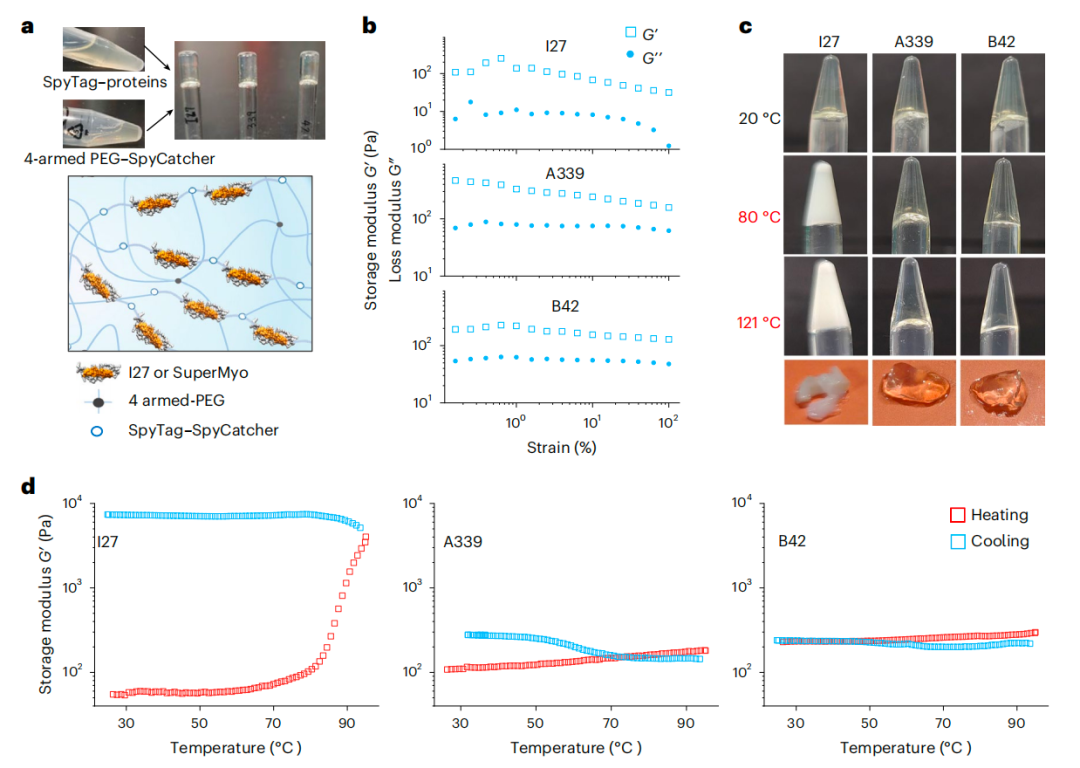
进一步实验验证显示,从头设计的 SuperMyo 的机械展开力随其氢键数量的增加而呈线性增长,其中性能最优的 SuperMyo 变体的展开力突破1000皮牛,达到天然肌联蛋白免疫球蛋白结构域的 5 倍以上,将蛋白质力学性能提升至纳牛级别。此外,该蛋白还展现出优异的热稳定性,熔解温度超过100 C,且在150 C 的极端高温下仍能保持结构与功能完整性。
更重要的是,这种分子层面的稳定性能够直接转化为宏观特性,由 SuperMyo 制成的热稳定水凝胶,能够在 121 C 的高压灭菌后仍能保持结构稳定与凝胶状态,相比之下,传统蛋白水凝胶在该条件下会变性沉淀。
总的来说,该研究提出了一种可扩展且高效的计算设计策略,用于从头设计稳健的蛋白质,为理性设计在极端环境中具有抗性的蛋白质系统提供了一种通用方法。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
搜索资讯
热门资讯
最新资讯
2025-05-01 16:06:26
2025-05-01 16:06:26
2025-05-01 16:06:26
2025-05-01 16:06:26
2025-05-01 16:06:26
2025-05-01 16:06:26