研究人员构建了一种针对Aβ蛋白的近红外荧光小分子探针
- 2022-04-27 00:00
- 来源:医药资讯网
- 阅读:143
阿尔茨海默病(AD)是一种严重的神经退行性疾病。其发病隐匿,病程长,病因复杂,严重影响患者,给其家庭和社会带来巨大的经济负担。AD的主要病理特征之一是-淀粉样蛋白(一种蛋白质)在患者大脑中的沉积。开发能够特异性靶向蛋白A,尤其是AD早期蛋白A的单体和寡聚体的分子影像探针,对于AD的早期发现和治疗,以及抗AD药物治疗效果的早期评估具有重要意义。
近日,中国科学院上海药物研究所研究员刘虹和南京大学化学化工学院教授叶德举合作构建了一种靶向蛋白A的近红外荧光小分子探针,并将其应用于转基因AD模型小鼠脑内蛋白A的实时荧光成像和可视化。这项成果发表在Theranostics杂志上,标题为“作为近红外荧光探针的供体-受体-供体姜黄素类似物的工程设计”,用于amyoid物种的体内成像。
近红外荧光成像因其灵敏度高、成像速度快、操作简单等优点,已广泛应用于疾病标志物的检测。近年来,研究人员已经成功开发了响应于蛋白A的荧光探针,用于蛋白A的检测.但已报道的大部分荧光探针仍存在一些缺点,如荧光发射波长短,与蛋白A结合动力学过程慢,亲和力低,只能检测AD晚期蛋白A的斑块。因此,开发具有近红外荧光发射波长、响应速度快、对蛋白质单体、寡聚体和聚集体亲和力高的近红外荧光探针,用于高灵敏度、高特异性地检测体内蛋白质,对AD的早期诊断和疗效监测具有重要意义。
基于蛋白质的结构和单体、寡聚物、聚集体的结合方式,通过合理设计和官能团替换,设计合成了9个具有供体-受体-供体(D-A-D)结构的近红外荧光探针(1-9),它们能够高特异性地结合蛋白质单体、寡聚物和聚集体,产生显著增强的近红外荧光信号。
本研究中发现的探针9具有红色近红外荧光发射波长和高荧光量子产率。一方面可以提高光线对颅骨和头皮的穿透深度,从而提高探针检测体内A蛋白的灵敏度。另一方面,可以减少探针在体内应用的剂量,从而降低高剂量探针对神经系统的潜在毒性。此外,由于探针9中引入了具有一定亲水性的羟乙基官能团,改善了探针的理化性能,增加了探针的脑渗透。同时,探针9表现出快速的结合动力学(120 s)、高的检测灵敏度和良好的选择性。本研究采用立式荧光显微镜对大脑微区进行实时动态荧光成像。发现探针9能快速穿透血脑屏障,进入脑实质,与脑内的A蛋白结合,产生激活的近红外荧光信号,从而有效区分转基因AD模型小鼠和对照野生型小鼠。
探针9可以高灵敏度、高特异性地检测蛋白A的单体、寡聚体和聚集体,并在体内有效地区分6月龄早期AD模型小鼠和对照野生型小鼠。可用于AD的准确诊断,进而用于AD的早期发现和干预治疗。探针9有望成为检测蛋白A的有效工具,可用于实时评估抗AD药物的治疗效果。
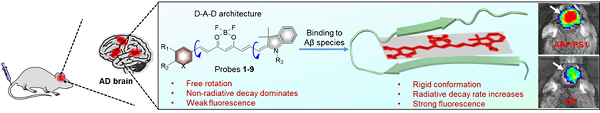
探针A蛋白反应机制示意图
