Nat Immunol:营养驱动免疫:GLP-2通过成纤维细胞重塑TSLP–ILC2–tuft回路
- 2025-12-02 00:00
- 来源:医药资讯网
- 阅读:431
来源:BioArt 2025-12-02 16:14
本研究发现小肠在进食后会迅速启动一条跨越内分泌、基质、免疫与上皮的信号通路。小肠黏膜既要吸收,又要抵御饮食来源的潜在危害,因此必须在上皮、基质、与内分泌之间建立高度协调的局部网络。多类先天淋巴细胞(包括ILC1/2/3、IEL、 T、ROR t⁺ APC与Tregs)与上皮和菌群共同调节吸收、免疫耐受、代谢以及黏膜保护,使小肠能在禁食、进食及昼夜节律变化中维持稳态【1,2】。然而,作为固有层最常见的组织驻留淋巴细胞之一,ILC2在无感染状态下长期存在,其真正的稳态功能始终缺乏明确解释。
之前研究发现,tuft细胞(簇细胞)释放的IL-25可激活ILC2,使其分泌IL-13并推动上皮向分泌谱系偏移,形成蠕虫感染中典型的 weep and sweep 回路【3】。IL-25信号若失控(如缺乏负调控因子A20),则即便没有感染也会诱导异常的II型免疫,提示稳态下必然具有更严格的阈值调控。由于IL-25、IL-33与TSLP均可激活ILC2,小肠中极有可能存在一个由多源警报素设定的 基础活化程序 ,并与进食等周期性生理刺激相耦合【4】。
近日,加州大学旧金山分校Richard M. Locksley实验室等在Nature Immunology杂志发表了题为TSLP links intestinal nutrient sensing with amplification of the ILC2 tuft cell circuit的研究文章,揭示了一条从进食到上皮重塑的连续信号通路,发现进食触发内分泌细胞释放GLP-2,GLP-2激活亚上皮成纤维细胞产生TSLP,TSLP驱动ILC2分泌IL-13,而IL-13通过上皮IL-4R 信号推动tuft细胞扩增。由此形成的GLP-2 TSLP ILC2 tuft回路,使小肠能够根据营养摄入情况动态调整上皮化学感受与屏障功能,为ILC2在稳态小肠中的存在提供了新的生物学解释。

Flare-TSLP 报告小鼠显示,TSLP在稳态下主要由PDGFR ⁺PDPN⁺成纤维细胞表达,这些细胞沿绒毛 隐窝轴连续分布,并呈绒毛端细胞与隐窝滋养细胞的经典空间模式。造血细胞和上皮细胞(包括 tuft 细胞)不表达 TSLP。流式分选与转录分析进一步确认这些亚上皮成纤维细胞携带维持、建立WNT/BMP梯度的标志性基因组合,在上皮维护中发挥了核心作用。因此,静息小鼠小肠TSLP主要来源于绒毛端细胞、滋养细胞及LECs等亚上皮成纤维细胞。
接下来作者发现小鼠16小时禁食后重新灌胃营养浆,TSLP⁺基质细胞与组织TSLP水平均迅速上升,并在2小时左右达到峰值;这一过程不依赖tuft细胞。进食4小时后,ILC2中IL-13报告信号增强,而在TSLPR缺失(全身或ILC2特异性)小鼠中,该反应大幅减弱。成纤维细胞特异性敲除TSLP同样削弱ILC2活化,而敲除淋巴内皮细胞TSLP则影响不大,表明进食相关的关键TSLP来源为亚上皮成纤维细胞。
单细胞RNA测序显示,TSLP⁺成纤维细胞高度富集Glp2r,而肠上皮和免疫细胞中表达极低。GLP-2激动剂给药可提升TSLP⁺成纤维细胞比例与TSLP蛋白,体外亦能诱导成纤维细胞与组织外植体分泌TSLP。mTOR、ERK、cAMP CREB轴的抑制可阻断这一效应。相应地,Glp2r⁻/⁻小鼠无法在进食后上调TSLP,也缺乏ILC2激活,进一步证明GLP-2为营养信号与ILC2回路之间的关键中枢。
在上皮层面,GLP-2给药可显著增加DCLK1⁺ tuft细胞数量,并依赖TSLPR、IL-13R 1与上皮IL-4R 。成纤维细胞特异性敲除TSLP同样削弱GLP-2诱导的tuft细胞扩增。利用CCK谱系驱动的DREADD激活肠内分泌细胞GPCR通路,也可在无进食刺激下提升ILC2活性并扩增tuft细胞,进一步确认GLP-2 TSLP ILC2 上皮IL-4R 轴构成了进食依赖簇细胞放大回路的关键信号。
此外,在寄生虫感染(如 T. muris)中,TSLP与GLP-2 TSLP轴同样部分参与ILC2激活,与寄生虫利用IL-25直接刺激tuft细胞的经典路线相互交织。由于寄生虫代谢物可绕过营养依赖的上游环节直接激活tuft细胞,它们能够在宿主小肠构建一个持续偏向II型免疫、利于自身生存的局部环境。
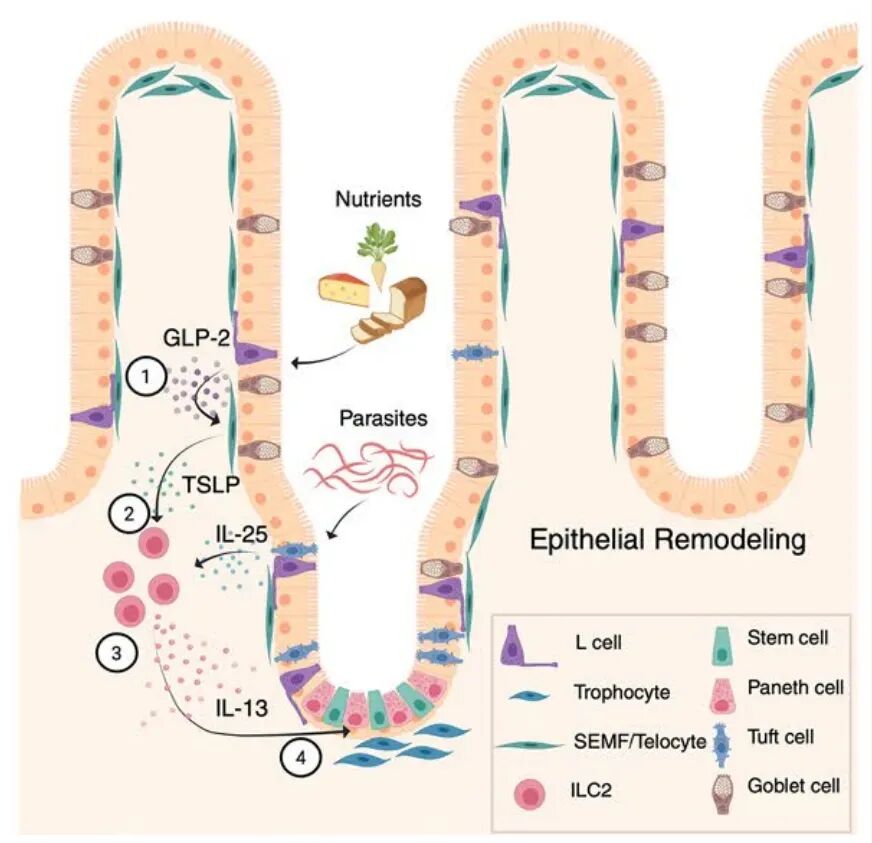
综上所述,本研究发现小肠在进食后会迅速启动一条跨越内分泌、基质、免疫与上皮的信号通路:肠内分泌细胞释放GLP-2,激活绒毛端细胞与隐窝滋养细胞上调 TSLP;TSLP随后驱动ILC2产生IL-13,使上皮向分泌谱系偏移并扩增tuft细胞,从而增强对饮食成分和寄生虫胁迫的化学感知能力。该GLP-2 TSLP ILC2 tuft回路揭示了ILC2在稳态小肠中的核心调节作用,并解释了营养感知如何被转译为上皮监视与局部免疫调控信号。
原文链接:
https://doi.org/10.1038/s41590-025-02328-y
