Cell Res:孙丽明团队发现功能性淀粉样蛋白纤维解聚酶抑制程序性细胞坏死
- 2023-08-18 00:00
- 来源:医药资讯网
- 阅读:285
来源:生物世界 2023-08-18 10:44
综上所述,该项工作报道了哺乳动物中的第一个蛋白纤维解聚酶amyloidase—HSPA8。HSPA8通过逆转RHIM蛋白纤维化,成为细胞内抑制程序性细胞坏死发生的关键检验点。中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)孙丽明研究组在Cell Research期刊发表了题为:HSPA8 acts as an amyloidase to suppress necroptosis by inhibiting and reversing functional amyloid formation的研究论文。
该研究发现HSPA8特异性识别RHIM蛋白,抑制其形成蛋白纤维;此外,HSPA8还具备蛋白纤维解聚酶(amyloidase)活性,能够将已经形成的RHIM蛋白纤维解聚成非激活形式的单体形式。在细胞和小鼠体内HSPA8通过抑制RHIM蛋白聚合和解聚RHIM蛋白纤维而抑制程序性细胞坏死。

该研究中研究人员首先通过全基因组siRNA筛选,发现HSPA8(也称为Hsc70)可以抑制细胞自发激活程序性细胞坏死。在细胞内敲低HSPA8促进了程序性细胞坏死的发生,敲除或抑制RIP3的激酶活性挽救了HSPA8敲低引起的细胞坏死增加;小分子化合物抑制HSPA8活性也促进了程序性细胞坏死信号的传递;说明在细胞中HSPA8抑制程序性细胞坏死。
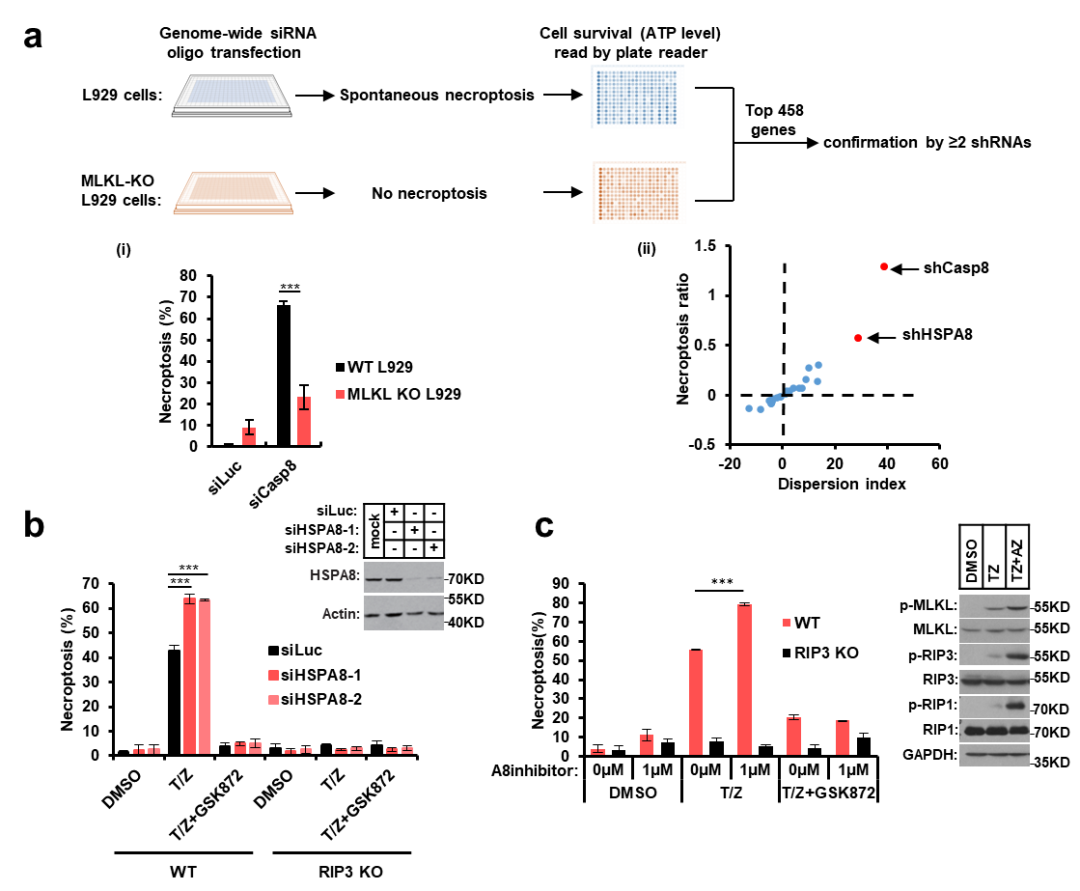
HSPA8抑制程序性细胞坏死
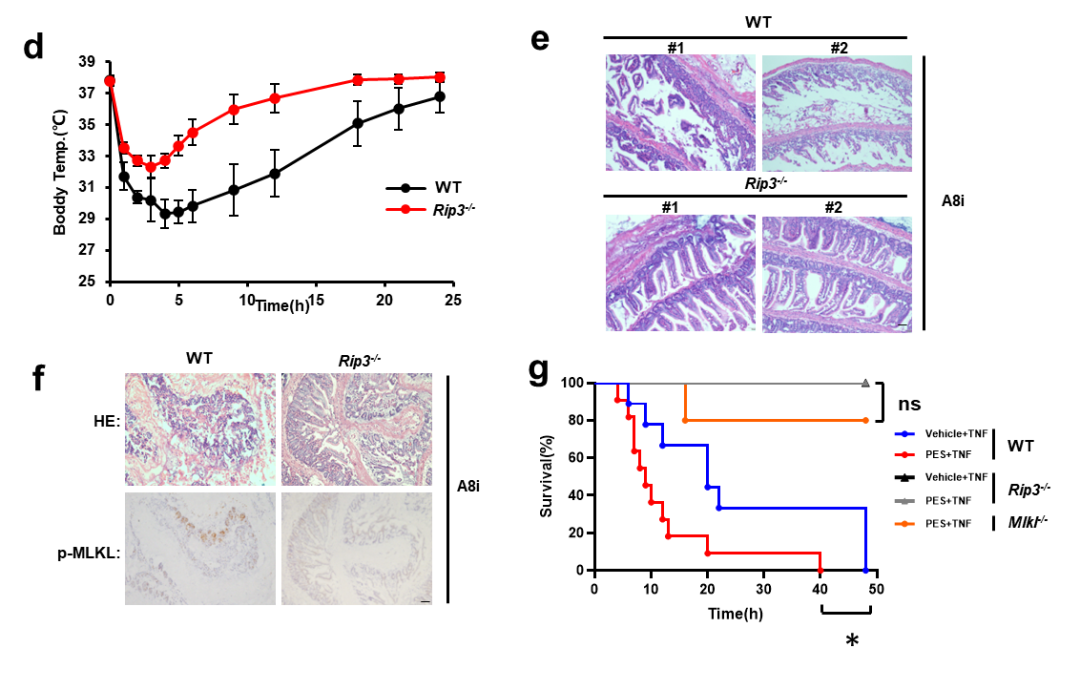
进一步研究发现在小鼠体内抑制HSPA8的活性,能够直接诱发程序性细胞坏死介导的体温失衡和肠道损伤,且能加重小鼠的全身性炎症反应综合征(SIRS)反应。敲除Rip3或Mlkl能够挽救HSPA8功能缺失所造成的组织损伤,验证了HSPA8在体内靶向程序性细胞坏死的特异性。